每日經濟新聞 2020-11-03 17:29:11
每經記者 金喆 每經編輯 魏官紅

丁香園Insight數據庫援引國家藥品監督管理局藥品審評中心數據顯示,10月16日~10月31日,中心共承辦528例申報進度,其中受理化藥申請410項,抗體類33項,多肽30項,血液制品相關11項,中藥申請10項,疫苗類10項,非抗體類蛋白7項,其他生物制品5項,基因治療3項,微生物相關2項,診斷試劑1項,輔料1項,細胞治療1項。
回顧10月下半月,共有一類新藥臨床申請數量27個,抗腫瘤藥物仍是主要研發方向。《每日經濟新聞》記者認為,本階段新藥研發的亮點如下:
1、麗珠集團注射用丹曲林鈉獲批上市;
2、信達生物PD-1第三季度銷售收入超人民幣6億元。
本階段,小分子藥物是創新藥研發的重點,抗腫瘤是首選領域。從靶點來看,醫藥企業在同一靶點上的研發競爭越來越激烈,基于同一靶點的創新藥研發同質化程度也越來越高。在競爭最激烈的PD-1/L1賽道,信達生物在第一梯隊的表現可圈可點。但最近,創新藥上市企業股價震蕩,主要是因為市場預計創新藥醫保談判結果將在今年底前出爐,多款產品面臨降價風險。
1、國產注射用丹曲林鈉獲批上市,對癥麻醉醫生的“恐怖夢魘”
10月24日,麗珠集團(000513,SZ)發布公告稱,已獲得“注射用丹曲林鈉”藥品注冊證書,歷經10年研發,適應癥為用于預防及治療惡性高熱。
每經點評:
惡性高熱是一種具有家族遺傳性的肌肉病。在沒有特異性治療藥物的情況下,一般的臨床降溫措施難以控制體溫增高,最終可導致患者死亡。在中國,惡性高熱是絕大多數麻醉醫生的“恐怖夢魘”——一方面,發病率極低(兒童發生率為1/15000,成人為1/50000),屬于罕見病,很多患者和非麻醉專業的醫務人員對惡性高熱意識不足;另一方面,死亡率極高(70%~80%),在“特效藥”丹曲林鈉出現后,死亡率將降到5%以下。
因此,歐美發達國家將丹曲林納作為醫院手術室的必備搶救藥物。在麗珠集團注射用丹曲林納獲批上市前,國內處于無藥可用的狀態。多年來,許多麻醉醫生一直在為國產或進口注射用丹曲林鈉的審批工作呼吁。麗珠集團相關人士對《每日經濟新聞》記者透露,當時研發這款藥是受臨床醫生的啟發和建議,公司從藥企的社會責任角度,針對這么一個罕見病來開發這樣的國內首仿藥品。
2009年,麗珠集團立項開發丹曲林納注射液,2014年申報臨床,2017年獲得優先審評資格。據了解,麗珠集團注射用丹曲林鈉累計投入研發費用1722.3萬元,目前未見其他廠家申報。
所謂巧婦難為無米之炊,丹曲林鈉上市后,能為麻醉醫生提供更充沛的藥物作為臨床選擇。
2、信達生物PD-1單季度賣6億元,明年還將有多項大適應癥獲批
信達生物(01801,HK)近日發布公告,旗下核心產品PD-1信迪利單抗(達伯舒)第三季度銷售額超人民幣6億元,前三個季度累計銷售額超人民幣15億元。
每經點評:
多家券商發布研報表示,符合預期。招商證券認為,其銷售增長強勁得益于公司在國內日趨完善的銷售網絡和醫保獨家優勢。“我們認為第四季度,信迪利單抗的銷售將繼續維持良好趨勢,全年銷售額有望突破21億元人民幣(這也意味著信迪利單抗第四季度銷售額有望超過我們預測的6億元人民幣)。”
招商證券指出,信迪利單抗的良好銷售趨勢,加上其2021年還有多項大適應癥將獲批上市,這些利好將繼續鞏固公司在中國PD-1市場的龍頭地位。
據《每日經濟新聞》記者了解,因近期市場預計創新藥醫保談判結果將在今年底前出爐,存在降價風險,近期,多家創新藥公司的股價走低,信達生物在10月下旬破頂后有所回調。招商證券認為,預計國家醫保局在醫保目錄調整過程中將采取較為穩健且循序漸進的節奏納入創新藥品種。
3、康方生物PD-1/VEGF雙抗Ia期臨床研究初步數據效果良好
在近日舉辦的2020中國腫瘤免疫治療會議上,康方生物發布了其自主研發的PD-1/VEGF雙特異性抗體(AK112)最新的Ia期劑量爬坡臨床研究初步數據,研究顯示,AK112針對PD-1不敏感型實體瘤患者效果良好。
每經點評:
AK112是康方生物第二款進入臨床的雙特異性抗體,也是全球首個進入臨床研究的PD-1/VEGF雙抗。康方生物高級副總裁金小平博士介紹稱,與聯合療法相比,AK112作為單一藥物同時阻斷這兩個靶點,可能會更有效地阻斷這兩個通路從而增強抗腫瘤活性和可能降低毒副作用。
目前AK112已經在澳洲和中國開展Ia期臨床研究,最初劑量遞增階段的臨床研究結果令人鼓舞。在有至少經歷過一次腫瘤評估并對PD-1抑制劑不敏感或接受過PD-1抑制劑治療的11例晚期實體瘤患者中,共有4例達到了緩解(客觀緩解率(ORR):36%),7例腫瘤縮小且疾病穩定(疾病控制率(DCR):64%)。
業內專家對《每日經濟新聞》記者表示,AK112的亮點在于對那些PD-1不敏感,或者使用過PD-1治療沒有效果的實體瘤,也有比較好的效果。不過現在的入組數量還比較少,只有11例。
1、本期首次注冊上市的品種有1個(如下圖所示),再注冊品種13個。

2、本階段申報的項目中,化藥仿制藥127項,化藥新藥/原研藥105項,生物制品新藥/原研藥35項,化藥改良型新藥8項,非原研/類似藥生物制品16項,生物制品改良型新藥2項,生物制品類似藥16項,暫時不明41項。本階段無品種被納入優先審評。

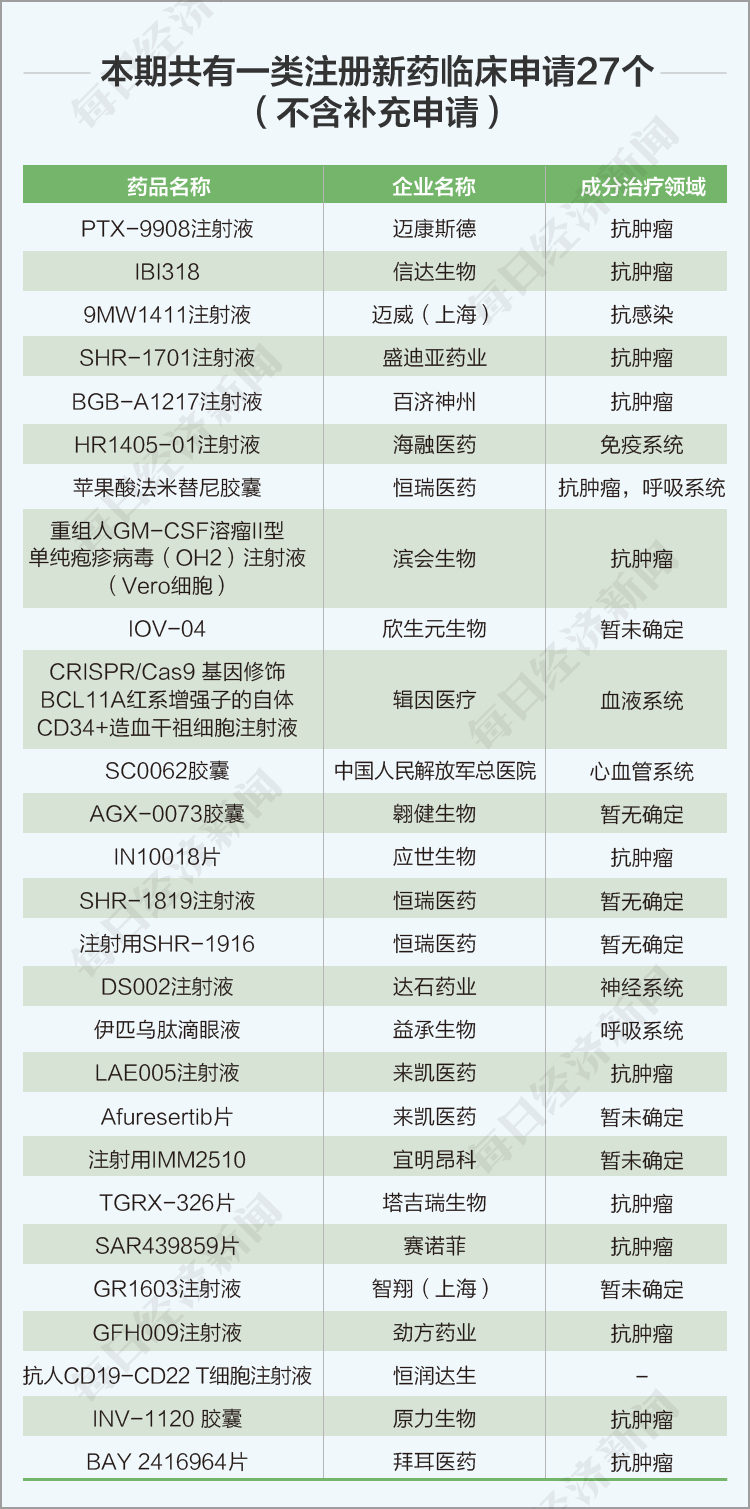
3、本期共有一類注冊新藥臨床申請27個(不含補充申請)。
封面圖片來源:攝圖網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
