每日經濟新聞 2019-11-05 00:19:07
國產創(chuàng)新藥甘露特鈉膠囊引爆輿論和市場,在全球約5000萬阿爾茨海默病患者只能依賴5款“老藥”的背景下,甘露特鈉膠囊的出現,引來患者關切和市場關注,但也在學術界引發(fā)了一些討論。
每經記者 滑昂 張瀟尹 每經編輯 文多
11月2日,國家藥監(jiān)局官網放出一條重磅消息,用于治療輕度至中度阿爾茨海默病的國產創(chuàng)新藥甘露特鈉膠囊(商品名“九期一”),被有條件批準上市。這也是全世界十七年來,再次有阿爾茨海默病新藥上市。
包括輝瑞、強生、葛蘭素史克等巨頭在內的一眾跨國藥企,曾集體在阿爾茨海默病藥物上折戟,燒錢百億卻無功而返。目前,全球有約5000萬阿爾茨海默病患者,卻只能依賴5款“老藥”。
《每日經濟新聞》記者注意到,九期一研發(fā)歷時長達22年。北京大學分子醫(yī)學研究所所長副主編肖瑞平認為:“(研發(fā)耗時長)這個一點都不稀奇,平均做一款新藥,即使在歐美發(fā)達國家也要14.7年,它如果能解決成千上萬患者的生命問題和疾苦問題,那也是值得的。”
圖片來源:中國科學院上海藥物研究所官網截圖
阿爾茨海默病(AD),多發(fā)于老年或老年前期。據國際阿爾茨海默病協會數據,2018年全球約有5000萬名患者。在我國,目前阿爾茨海默病患者約1000萬人。
但如此龐大的患者群體,在臨床上的用藥選擇卻不多。廣東三九腦科醫(yī)院神經內六科主任胡運新告訴《每日經濟新聞》記者,目前國內用于治療阿爾茨海默病的藥物,主要包含膽堿酯酶抑制劑、NMDA受體拮抗劑兩大類。涉及藥物包括多奈哌齊、卡巴拉汀、美金剛和加蘭他敏四款。
在美國,FDA批準可用于治療阿爾茨海默病的藥物只比國內多一款他克林。“但這些藥物,都只能緩解阿爾茨海默病的癥狀,不能治愈。”胡運新介紹說。
因此,九期一11月2日獲批后,胡運新很快就在醫(yī)院里遇到了前來詢問新藥的患者。
“確實是之前的藥物,對改善阿爾茨海默病在記憶力衰退方面的效果不是很理想。大家總是很期待,能真的出現一個可以從根本上改善阿爾茨海默病的藥物。”胡運新向《每日經濟新聞》記者說道。
公開資料顯示,九期一研發(fā)始于1997年,對于這樣一款研發(fā)周期長達22年的國產創(chuàng)新藥。“它如果能解決成千上萬患者的生命問題和疾苦問題,那也是值得的。”11月3日,北京大學分子醫(yī)學研究所所長、《新英格蘭醫(yī)學雜志》副主編肖瑞平對該藥評價道。

圖片來源:《2018年世界阿爾茨海默病報告》PDF文件截圖
龐大的患者群體帶來了巨大的市場需求。國際阿爾茨海默病協會的估算是,2018年全球阿爾茨海默癥的醫(yī)護總成本為1萬億美元,到2030年,這一數值將上升至2萬億美元。這也讓中外生物制藥企業(yè)紛紛瞄準阿爾茨海默病進行新藥研發(fā)。《第一財經》2018年的報道中提到,全球阿爾茨海默病藥品研發(fā)成本超過2000億美元。
但巨大的研發(fā)熱情并沒有換來想象中成批的新藥上市。據國內醫(yī)藥論壇“同寫意”統計稱,全世界范圍內于2000年后終止的阿爾茨海默病新藥研究已經超過30個,其中半數以上在研藥物因為沒有達到臨床試驗主要終點(專業(yè)術語,指主要結局指標)而宣告失敗。這其中,包括輝瑞、強生、葛蘭素史克、禮來等巨頭在內都曾“踩雷”。
另據國際阿爾茨海默病協會《2018年世界阿爾茨海默病報告》顯示,1998年后,已有100多次基于阿爾茨海默新藥開發(fā)嘗試,但只有4款藥物(療法)被認可。
這其中,美國藥企渤健公司(Biogen)迎來過一次“峰回路轉”。2019年10月22日,該公司與其合作伙伴日本衛(wèi)材(Eisai)宣布,重啟阿爾茨海默癥治療藥物阿杜卡單抗(Aducanumab)的研發(fā),并擬于2020年初向美國FDA提交上市申請。而在2019年3月,上述兩家公司曾宣布研發(fā)因臨床試驗數據不佳終止。
國內藥企方面,《每日經濟新聞》記者梳理發(fā)現,除了綠谷制藥此次獲批的新藥九期一,國內還有其他公司也在開展研究。中國科學院上海藥物研究所官網顯示,抗阿爾茨海默癥新藥氟諾哌齊獲批進入臨床研究,該項目已與江蘇康緣藥業(yè)股份有限公司達成合作協議,實現了成果轉讓。
圖片來源:中國科學院上海藥物研究所官網截圖
新華制藥的公告也顯示,2018年1月,新華制藥與沈陽藥科大學簽訂了技術開發(fā)(委托)合同,開展阿爾茨海默病創(chuàng)新藥物OAB-14及制劑開發(fā)。

圖片來源:新華制藥公告截圖
不過,受制于研發(fā)投入大、研發(fā)成功率低等因素,當前國內藥企對阿爾茨海默病的布局依舊以原料藥和仿制藥為主。2018年6月,京新藥業(yè)宣布公司旗下重酒石酸卡巴拉汀膠囊獲批,該藥物為諾華制藥卡巴拉汀的首仿藥。此外,還有一些藥企通過仿制多奈哌齊片打入阿爾茨海默病藥物市場,記者查詢發(fā)現,海正藥業(yè)、藍豐生化、圣濟堂等藥企均有與多奈哌齊片相關的產品。
11月4日開盤后,受九期一獲批上市消息的影響,阿爾茲海默病概念股大漲,藍豐生化、京新藥業(yè)漲停。
上文提到的渤健公司,在宣布與合作伙伴重啟阿爾茨海默病新藥研發(fā)后,兩家公司股票都順勢上漲。但外界質疑,原本數據不佳的臨床試驗為何后來又出現了差異?
《每日經濟新聞》記者注意到,按照渤健公司在其官網的表述,阿杜卡單抗此前有兩項名為ENGAGE(1638例患者)、EMERGE(1647例患者)的III期臨床試驗,已于2019年3月停止,但并非所有入組患者都完成了預期治療。此后,陸續(xù)又有新的入組患者繼續(xù)按設計完成了18個月的完整治療。基于新的、更多的數據來源,讓EMERGE組達到了其預先設定的主要終點。此外,接受高劑量阿杜卡單抗治療的患者身上,也體現出了更佳的數據。
“就算我們接受這個本身就很牽強的解釋,那也意味著阿杜卡單抗(Aducanumab)是一個非常難以駕馭的藥物——必須用足夠的量才有效,用得稍微少一點可能就完全沒用甚至還有害。”浙江大學生命科學研究院教授王立銘在科普平臺“知識分子”上發(fā)表文章如此表示。
而九期一在經歷獲批上市后的贊譽后,也遇到一些學術上的不同聲音。與此前上市的任何一款阿爾茨海默病藥物不同,九期一是世界首個靶向腦-腸軸的阿爾茨海默病治療新藥,且藥物本身屬于低分子酸性寡糖化合物。這樣的藥物機理讓九期一顯得過于“與眾不同”。
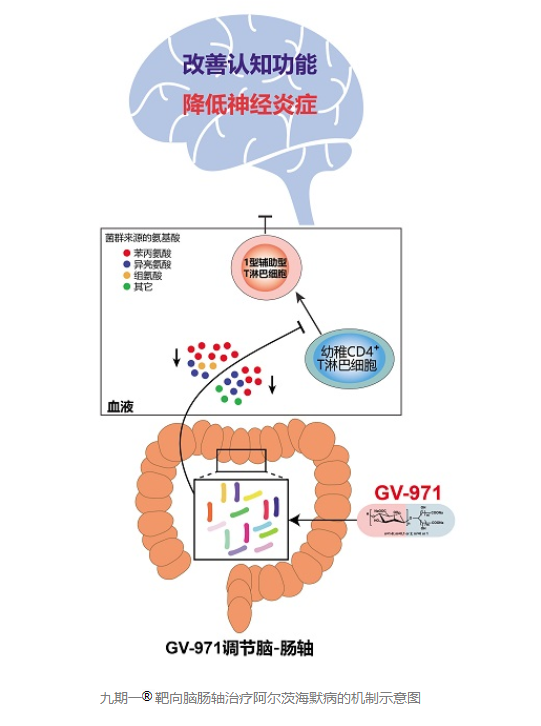
圖片來源:中國科學院上海藥物研究所官網截圖
“這款藥物的動物實驗結果發(fā)表在Cell Research上,提出機制可能是通過靶向腸道菌群,影響大腦,降低神經炎癥。然而在人類試驗中,我們沒有看到降低神經炎癥的任何數據。”微博認證為“科學松鼠會成員/果殼網生物領域達人”的“冷月如霜”在個人平臺上寫道。在這位“冷月如霜”看來,“上市后繼續(xù)進行藥理機制方面的研究和長期安全性有效性研究”是國家藥監(jiān)局對九期一批準有條件上市的原因之一。這樣的觀點,在眾多質疑九期一的聲音中,頗具代表性。
對于“有條件獲批上市”,九期一主要發(fā)明人、中國科學院上海藥物研究所學術所長耿美玉此前接受媒體采訪時解釋道:“‘有條件’審批是因為在新藥申報資料中,關于大鼠長期致癌性試驗正式報告沒有提交,但是試驗已經完成,統計結果也已全部完成。”

圖片來源:中國科學院上海藥物研究所官網截圖
但一位醫(yī)藥行業(yè)分析師告訴《每日經濟新聞》記者,在還沒看到進一步臨床數據的前提下,如果學術界之后有非常大的反彈,或將影響藥品前景。
封面圖片來源:攝圖網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
